- Model atom Democritus
Dalam pengertian kita mengenai arti kata “model”, Democritus belum bisa dikatakan sebagai telah menyusun suatu model atom. Democritus
(460 SM – 440 SM, Yunani) menyampaikan gagasan yang bersifat abstrak
tentang atom dalam upaya pencariannya terhadap elemen-elemen penyusun
materi. Menurut Democrius, materi tidak dapat terus menerus diperkecil
dimensinya. Bila terus dilakukan, proses pembagian/pemotongan suatu
materi akan sampai pada suatu kondisi dimana dimensi materi tersebut
tidak dapat dibagi lagi. Elemen terkecil dari materi tersebut ia sebut sebagai atomos yang berarti tak terbagi
lagi. Democritus mempostulasikan bahwa alam semesta hanya terdiri dari
ruang kosong dan atom-atom. Berdasarkan postulat tersebut, ia
mengemukakan teori atomnya yang dapat dinyatakan sbb.: semua materi
terdiri dari partikel-partikel yang tidak dapat dilihat yang disebut
atom, atom tidak dapat dihancurkan dan tidak dapat dipotong atau dibagi
lagi, ruang kosong (void) berada diantara atom-atom, atom-atom
adalah berupa padatan dan bersifat homogen, atom-atom berbeda dalam
ukuran, bentuk, masa, posisi, dan susunannya.
Tinjauan
filsafat bedasarkan eksperimen logika ini dianggap sebagai model
kualitatif pertama mengenai atom. Model atom Democritus ini dapat
bertahan selama lebih dari 2000 tahun. Alasan yang membuatnya dapat
bertahan begitu lama karena model atom ini tidak dapat diuji baik oleh
teori maupun secara eksperimen. Hal ini dapat dimengerti mengingat
sampai abad 16, era sebelum Galileo (Galileo Galilei, 1564 –
1642, Italia) lahir, kaidah-kaidah penelitian berdasarkan metoda ilmiah
belum dirumuskan. Alasan lain adalah bahwa sampai abad 19 belum
tersedia peralatan untuk eksperimen-eksperimen fisika “modern” khususnya
untuk ekperimen-ekesperimen pada objek dalam skala atomik. Selain itu,
sampai abad 18 tema mengenai investigasi atom ini belum menjadi minat
penelitian para fisikawan. Eksistensi atom baru menarik perhatian
kalangan ilmiah pada tahun 1900, setelah Einstein melakukan perhitungan
mengenai prediksi gerak Brown yang kemudian diverifikasi oleh eksperimen
Perrin (Jean Perrin, 1870 – 1942, Perancis).
- Model atom Dalton
Dalam ilmu Kimia abad 18 telah dikenal dua hukum mengenai senyawa: hukum kekekalan masa Lavoisier (Antoine Laurent de Lavoisier, 1743 – 1794, Perancis) dan hukum perbandingan tetap Proust (Joseph Louis Proust, 1754 – 1826, Perancis). Lavoiser menyatakan bahwa “Massa total zat-zat sebelum reaksi akan selalu sama
dengan massa total zat-zat hasil reaksi”. Sedangkan Proust menyatakan
bahwa “Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap”.
Berdasarkan kedua hukum tersebut serta hasil eksperimen yang
dilakukanya sendiri, tahun 1808 Dalton (John Dalton, 1766 – 1844, Inggris) seorang ahli Kimia mengajukan sebuah model atom.
Secara
kualitatif sebagian model atom Dalton ini sama dengan model atom yang
dikemukakan oleh Democritus. Dalton menyatakan bahwa: semua materi
terdiri dari partikel-partkel sangat kecil yang tidak dapat dipecah lagi
yang disebut atom-atom, atom-atom pada unsur yang sama adalah identik,
atom-atom pada unsur yang berbeda memiliki masa yang berbeda, atom-atom
unsur-unsur yang berbeda dapat bergabung dengan
perbandingan tetap membentuk suatu senyawa, atom-atom menyusun dirinya
saat reaksi kimia berlangsung, atom berupa bola pejal kecil yang sangat
keras yang memiliki kait (hook) untuk berikatan dengan atom
lainya. Dalton menggambarkan atom-atom unsur menggunakan simbol-simbol
seperti ditunjukan pada gambar 1.
Meskipun secara kualitatif model atom Dalton ini sama dengan model atom Democritus, Dalton dianggap sebagai orang
pertama yang membangun teori atom modern dan berhasil mengkaitkan
konsep atom dengan prinsip-prinsip stoikiometri. Selain itu, model atom
Dalton juga telah membantu memahami lebih dalam mengenai konsep molekul.
Di luar keberhasilanya tersebut, model atom Dalton masih belum bisa
menjelaskan secara kuantitatif mengenai atom serta belum dapat menjawab
pertanyaan tentang struktur atau komposisi dari atom.
- Model atom Thomson-Kelvin
Crookes (William Crookes,
1832 – 1919, Inggris) merupakan salah seorang penemu tabung hampa udara
yang digunakan untuk eksperimen lucutan muatan listrik pada gas. Tabung
ini dikenal sebagai tabung Crookes atau tabung sinar katoda.
Eksperimen-eksperimen menggunakan tabung ini biasa disebut sebagai eksperimen
sinar katoda. Dalam salah satu eksperimennya, Crookes menemukan bahwa
sinar yang berasal dari salah satu elektroda (katoda) bergerak lurus,
menyebabkan fosforisensi pada objek-objek yang dikenainya, serta
menimbulkan panas yang tinggi. Crookes mengajukan teori bahwa ia telah
menemukan bentuk ke-4 dari keadaan materi yang ia sebut sebagai “radiant matter”. Crookes juga meyakini bahwa berkas sinar katoda tersebut terdiri dari partikel-partikel berukuran molekular.
Teori Crookes tersebut terbukti keliru setelah Thomson (Joseph John Thomson,
1856 – 1940, Inggris) melakukan eksperimen menggunakan tabung sinar
katoda dan berhasil mengidentifikasi bahwa sinar katoda tersebut adalah
berkas partikel bermuatan negatif yang memiliki masa 1/1800 kali masa
atom hidrogen. Dari beberapa eksperimen yang dilakukan, Thomson
menyimpulkan bahwa partikel negatif tersebut merupakan partikel
subatomik yang merupakan partikel fundamental pembentuk atom dan
terdapat pada semua unsur/elemen kimia. Partikel bermuatan negatif
tersebut kemudian dikenal sebagai elektron. Thomson menemukan elektron
tersebut pada tahun 1891, hal ini membuatnya dikenal sebagai Bapak
penemu elektron.
Berdasarkan investigasi sinar katoda tersebut dan ide yang dikemukakan oleh Lord Kelvin (William Thomson,
1824 – 1907, Inggris), pada tahun 1904 Thomson mengajukan model atom
yang dikenal sebagai model kue kismis. Model atom Thomson seperti
diilustrasikan pada gambar 2, digambarkan sebagai bola bermuatan positif
dengan elektron-elektron tersebar secara merata di dalam bola tersebut
sehingga secara keseluruhan atom besifat netral. Analogi yang mungkin
lebih mudah dibayangkan (meskipun tidak benar-benar tepat) adalah bila
model atom Thomson tersebut digambarkan seperti buah semangka dimana
daging semangka merepresentasikan bagian yang bermuatan positif
sedangkan biji-biji semangka merepresentasikan elektron-elektron yang
bermuatan negatif.
- Model atom Rutherford
Model atom yang dikemukakan Thomson perlu diuji kebenaranya. Rutherford (Ernest Rutherford,
1871 – 1937, Inggris) melakukan eksperimen untuk menginvestigasi
struktur internal atom sekaligus menguji model atom Thomson. Pada tahun
1909, dibawah supervisi Rutherford, dua mahasiswanya, Geiger (Johannes Wilhelm Geiger, 1882 – 1945, Jerman) dan Marsden (Ernest Marsden,
1889 – 1970, Jerman) melakukan eksperimen penembakan lempeng tipis emas
dengan partikel alfa. Eksperimen ini, yang dikenal sebagai eksperimen
Geiger-Marsden, merupakan eksperimen difraksi partikel alfa oleh
atom-atom emas. Eksperimen Geiger-Marsden tersebut diilustrasikan secara
skematik seperti pada gambar 3.
Saat eksperimen, diamati bahwa sebagian besar partikel alfa dihamburkan (scattered)
dengan sudut kurang dari 1º dan lewat menembus lempengan emas. Hal ini
cocok dengan prediksi menurut model atom Thomson. Namun demikian,
ternyata ada sebagian kecil partikel alfa yang dihamburkan dengan sudut
lebih dari 10º bahkan ada pula yang dipantulkan balik 180º. Komentar
Rutherford yang terkenal mengenai data eksperimen ini adalah:
“Benar-benar tidak masuk akal. Ini seperti menembakan peluru sebesar 38
centimeter ke selembar kertas tisu, namun peluru tersebut malah
dipantulkan balik”.
Dari
hasil-hasil eksperimen Geiger-Marsden ini dan perhitungan yang ia
lakukan, Ruhterford menyimpulkan bahwa hampir sebagian besar struktur
atom berupa ruang kosong, atom memiliki inti yang sangat kecil, masif,
bermuatan positif yang sangat besar, inti atom hanya menempati ruang
sebesar 10-6 kali ruang atom. Berdasarkan
argumentasi-argumentasi tersebut, pada tahun 1911 Rutherford
mengemukakan model/teori atomnya sbb.: atom terdiri dari inti bermuatan
positif dengan elektron berputar mengelilingi inti, gaya tarik
elektrostatik akan menghasilkan gaya sentripetal yang dapat
mempertahankan elektron-elektron bergerak pada orbitnya masing-masing,
antara inti atom dengan elektron berupa ruang kosong. Model atom
Rutherford diilustrasikan seperti pada gambar 4.
Model
atom Rutherford ini mirip dengan model tatasurya, di mana matahari
sebagai inti atom dan planet-planet sebagai elektron. Berkat hasil
eksperimen lempeng tipis emas dan model atomnya tersebut, Ruhterford
diakui sebagai penemu inti atom dan model atom yang dia kemukakan
dikenal pula sebagai model inti.
Selain data hasil eksperimen lempeng tipis emas, perhitungan kuat medan listrik menggunakan hukum Gauss (Johann Carl Friedrich Gauss,
1777 – 1855, Jerman) membuktikan bahwa model atom Rutherford lebih
valid dibanding model atom Thomson. Perhitungan dengan menggunakan model
atom Thomson menghasilkan kuat medan listrik sebesar 1,1, x 1013 N/C.
Kuat medan listrik sebesar ini tidak akan mampu memantul balikan
partikel alfa. Sedangkan perhitungan menggunakan model atom Rutherford
menghasilkan kuat medan listrik sebesar 2,3 x 1021 N/C. Kuat
medan listrik pada model atom Rutherford yang sangat besar inilah yang
mampu memantul balikan partikel alfa yang bermuatan +2e.
Rutherford
telah berhasil menemukan struktur atom. Namun demikian, model atom yang
ia bangun tidak dapat menjawab pertanyaan-pertanyaan seperti: bagaimana
susunan elektron di sekitar inti, bagaimana struktur inti atom, mengapa
elektron negatif tidak jatuh ke dalam inti positif, dan pertanyaan
fundamental lainya.
- Model atom Bohr
Keberatan
lain terhadap model atom yang dikemukakan Rutherford adalah, menurut
teori mekanika klasik dan teori elektrodinamika klasik, suatu partikel
bermuatan yang bergerak melingkar akan mengalami percepatan. Partikel
bermuatan yang dipercepat akan kehilangan energinya dalam bentuk radiasi
gelombang elektromagnetik. Karena energinya terus menerus berkurang,
maka semakin lama lintasan elektron akan semakin mengecil membentuk
spiral dan bila eneginya telah habis maka elektron akan jatuh ke dalam
inti. Dengan argumentasi ini, elektron akan jatuh ke dalam inti dalam
waktu sepersekian detik. Dengan demikian menurut model atom Rutherford
tidak akan ada atom yang stabil. Hal ini tentu saja bertentangan dengan
realitas di mana atom unsur-unsur di alam bersifat stabil.
Masalah ketidak stabilan atom pada model Rutherford ini dijawab oleh Bohr (Niels Henrik David Bohr, 1885 – 1962, Denmark). Dengan menggunakan formulasi kuantum Planck (Max Planck, 1858 – 1947, Jerman) dan Einstein (Albert Einstein, 1879 – 1955, Jerman) dan diilhami oleh rumus Balmer (Johann Jacob Balmer,
1825 – 1898, Swiss) untuk menghitung frekuensi transisi radiatif pada
spektrum emisi atom hidrogen, Bohr pada tahun 1913 mengajukan sebuah
model atom melalui postulatnya yang dinyatakan sbb.:
- Sebuah
elektron bererak di sekitar inti dalam orbit lingkaran tanpa
memancarkan radiasi sehingga energi totalnya tetap. Orbit tersebut
dinamakan keadaan stasioner
- Orbit stasioner memiliki momentum sudut diskrit L = mvr = nh/2π , dimana m dan v masing masing adalah masa dan kecepatan linier elektron, r: jari-jari orbit stasioner, n: bilangan bulat (= 0,1,2,3…), dan h: konstanta Planck.
- Transisi
elektron dari satu orbit stasioner ke orbit stasioner lainya akan
menghasilkan pancaran atau serapan radiasi gelombang elektromagnetik
dengan frekuensi hf = Ef - Ei , dimana Ei dan Ef merupakan energi atom awal dan akhir dalam keadaan stasioner.
Bohr
dengan model atomnya tersebut mampu menjelaskan kestabilan atom serta
dapat menurunkan persamaan transisi radiatif pada deret spektral emisi
dan absorpsi atom hidrogen (persamaan 1) yang hampir 90 tahun sebelumnya
telah diturunkan oleh Balmer secara empirik melalui manipulasi numerik.
Garis-garis spektral emisi atom higrogen tersebut dikenal sebagai deret
Balmer. Gambar 5 memperlihatkan deret Balmer atom hidrogen.
f = 2π2mq4/(nf-2-ni-2) (1)
dimana f: frekuensi transisi radiatif, m: masa elektorn, q: muatan elektron, ni dan nf merupakan bilangan-bilangan bulat yang masing-masing menyatakan orbit stasioner awal dan akhir transisi.
 |
| Gambar 5. Deret Balmer spektrum emisi atom hidrogen [4] |
Model
atom Bohr dianggap sebagai model atom kuantum pertama karena model ini
dibangun dengan memadukanan teori mekanika klasik dengan prinsip-prinsip
fisika kuantum. Bilangan n pada persamaan (1), yang
disebut sebagai bilangan kuantum utama merupakan karakteristik yang
menyatakan keadaan tingkat energi (energy eigen state) elektron
pada suatu atom. Namun demikian, model atom Bohr ini belum dianggap
sebagai model atom yang lengkap dan benar karena model tersebut hanya
dapat memprediksi dengan tepat struktur atom yang memiliki elektron
tunggal (hidrogen) saja, namun tidak mampu menjelaskan struktur atom
berelektron banyak.
Selain
itu, model atom Bohr tidak dapat menjelaskan mengapa intensitas garis
spektral tertentu lebih tinggi dibanding intensitas garis spektral lain,
atau dengan kata lain mengapa peluang transisi antara tingkat energi
tertentu lebih besar dibanding transisi pada tingkat energi lainya.
Tantangan lain terhadap model atom Bohr ini adalah bahwa model ini tidak
dapat menjelaskan bagaimana mekanisme interaksi atom-atom dalam
membentuk kumpulan makroskopik dari materi yang memiliki sifat fisis dan
kimiawi seperti unsur, molekul, dan zat: solid, liquid, dan gas.
- Model atom Mekanika Kuantum
Selain
beberapa persoalan seperti dikemukakan di atas, model atom Bohr juga
tidak dapat menjelaskan hasil eksperimen spektroskopi atom yang
menghasilkan lebih banyak (splitting) spektrum garis-garis yang
lain dalam atom hidrogen. Hal ini menunjukan bahwa identitas atom atau
elektron tidak cukup hanya direpresentasikan melalui satu karakteristik
saja yakni bilangan kuantum utama, n, namun diperlukan bilangan kuantum lain untuk menjelaskan fenomena splitting garis-garis spektral ini.
Sommerfeld (Arnold Sommerfeld, 1868 – 1951, Jerman) memperluas gagasan Bohr dengan mengajukan berbagai orbit elips untuk harga n
yang sama. Menurut perhitungan Sommerfeld, elektron memiliki energi
orbit sedikit lebih besar atau lebih kecil dibanding enrgi orbit
stasioner Bohr. Tingkat-tingkat energi inilah yang menghasilkan berbagai
garis spektrum tambahan seperti diamati pada eksperimen. Sommerfeld
menentukan batasan lain untuk orbit elektron ini yang disebut sebagai
bilangan kuantum orbital, l, dimana l harus berharga 0 , 1, 2, …, (n - 1). Batasan harga bilangan kuantum orbital l tersebut memiliki konsekuensi bahwa elektron hanya dapat memiliki momentum sudut L sebesar
L = (l(l+1)h/2π)1/2 (2)
Sommerfeld juga dapat menjelaskan gejala fisika lain yang dikenal sebagai efek Zeeman (Pieter Zeeman,
1865 – 1943, Belanda). Efek Zeeman, seperti diilustrasikan pada gambar
6, merupakan pengamatan adanya lebih banyak garis spektrum tambahan bila
suatu atom yang tereksitasi ditempatkan dalam medan magnetik.
 |
| Gambar 6. Efek Zeeman, terpisahnya garis spektral akibat medan magnetik [5] |
Model
atom Bohr-Sommerfeld ini melengkapi model Bohr sebelumya dengan
menambahkan aturan seleksi pada proses transisi elektron berdasarkan
tiga bilangan kuantum, yakni bilangan kuantum utama/ukuran orbit, n, bilangan kuantum bentuk orbit, l, dan bilangan kuantum arah orbit, ml. Transisi antar tingkat energi inilah yang diamati sebagai garis-garis spektrum.
Model atom Bohr-Sommerfeld mengalami masalah ketika tidak mampu menjelaskan gejala lain yang dikenal sebagai AEZ – Anomali Efek Zeeman. AEZ merupakan fenomena dimana ditemukan lebih banyak lagi garis spektrum (selain garis-garis spektrum pada efek Zeeman) akibat pengaruh medan magnetik. Para fisikawan pada saat itu meyakini bahwa diperlukan bilangan kuantum tambahan untuk menjelaskan gejala AEZ tersebut.
Model atom Bohr-Sommerfeld mengalami masalah ketika tidak mampu menjelaskan gejala lain yang dikenal sebagai AEZ – Anomali Efek Zeeman. AEZ merupakan fenomena dimana ditemukan lebih banyak lagi garis spektrum (selain garis-garis spektrum pada efek Zeeman) akibat pengaruh medan magnetik. Para fisikawan pada saat itu meyakini bahwa diperlukan bilangan kuantum tambahan untuk menjelaskan gejala AEZ tersebut.
Penjelasan fenomena AEZ ini diberikan oleh Pauli (Wolfgang Pauli,
1924 – 1958, Swiss) melalui hipotesisnya bahwa elektron memiliki spin
intrinsik yang berkontribusi terhadap penambahan momentum sudut total
atom. Untuk menjelaskan fenomena AEZ, Pauli mengusulkan bilangan kuantum
ke empat yang hanya dapat memiliki dua harga saja. Ide yang sama
mengenai spin elektron ini dimiliki pula oleh Goudsmit (Samuel Abraham Goudsmit, 1902 — 1978, Belanda) dan Uhlenbeck (George Eugene Uhlenbeck, 1900 – 1988, Belanda). Pada tahun 1925, atas dukungan profesor mereka, Ehrenfest (Paul Ehrenfest,
1880 – 1933, Austria) Goudsmith-Uhlenbeck mengajukan hipotesis bahwa
elektron memiliki momentum sudut intrinsik yang bebas dari momentum
sudut orbitalnya dan momentum sudut intrinsik ini berkaitan dengan momen
magnetik elektron.
Bilangan kuantum ke empat, s, digunakan untuk menyatakan momentum sudut spin elektron tersebut. Menurut teori Dirac (Paul Adrien Maurice Dirac, 1902 – 1984, Inggris), bilangan kuantum ini hanya boleh memiliki harga s = ½. Momentum sudut total atom akibat spin elektron ini besarnya adalah:
S = (s(s+1)h/2π)1/2 = 31/2h/4π (3)
Spin
elektron mengalami kuantisasi ruang seperti halnya vektor momentum
sudut orbital. Kuantisasi ruang spin elektron ini dinyatakan dengan
bilangan kuantum magnetik spin ms yang memiliki harga ms = +½ dan ms = -½. Adanya kuantisasi ruang spin elektron ini dibuktikan melalui eksperimen yang dilakukan oleh Stern (Otto Stern, 1888 – 1969, Jerman) dan Gerlacht (Walter Gerlacht, 1889 - 1979, Jerman) pada tahun 1922.
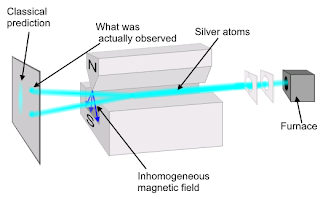
Stern-Gerlach
melakukan eksperimen untuk membuktikan bahwa partikel (elektron dalam
hal ini) memiliki momentum sudut intrinsik. Skematik eksperimen
Stern-Gerlacht diilustrasikan seperti pada gambar 7. Atom-atom perak
diuapkan di dalam oven bergerak melalui kolimator-kolimator celah sempit
sampai melewati kutub-kutub medan magnet yang memiliki kuat medan
magnet dipol dalam arah sumbu Z sebesar mz. Karena atom perak ini memiliki momen magnetik, maka akan mengalami defleksi dengan gaya magnetik:
FZ = mz¶Bz/¶Z (4)
Dari
hasil eksperimen diperoleh bahwa vektor momen magnetik dari atom yang
ditempatkan pada medan magnetik eksternal hanya memiliki dua arah saja
seperti ditunjukan pada gambar 7.
Selain dapat menjelaskan gejala AEZ melalui kuantisasi ruang spin
magnetik elektron, Pauli berhasil pula menjawab pertanyaan mengapa semua
elektron yang berada pada masing-masing tingkat energi, tidak jatuh ke
dalam tingkat energi dasar – ground state – yang merupakan
tingkat energi terendah dan paling dekat ke inti atom. Menurut Pauli,
setiap keadaan atom yang direpresentasikan dengan bilangan kuantum n, l, dan ml
memiliki dua elektron dengan orbitnya masing-masing. Dengan konsep spin
dua nilai tersebut Pauli mengemukakan sebuah prinsip yang dikenal
sebagai Prinsip Larangan Pauli. Prinsip tersebut secara sederhana
menyatakan bahwa tidak ada 2 elektron dalam suatu atom dapat memiliki
ke-4 bilangan kuantum sama. Ini berarti bahwa masing-masing keadaan
kuantum dalam atom hanya dibatasi satu elektron. Jadi ada empat bilangan
kuantum dengan dua harga spin: spin atas dan spin bawah untuk setiap
tingkat energi. Jika suatu keadaan telah tercapai, elektron berikutnya
harus mencapai tingkat energi di atasnya yang masih kosong. Inilah
sebabnya mengapa elektron-elektron pada atom tidak jatuh ke tingkat
dasarnya dan teori Pauli ini mampu menjelaskan mengapa setiap atom
memiliki karakteristik struktur yang berbeda untuk masing-masing unsur.
Pauli
telah memperluas hipotesis-hipotesis sebelumnya yang hanya menyangkut
karakteristik elektron terluar saja. Prinsip Pauli ini berlaku bukan
hanya untuk elekrtron valensi saja namun berlaku untuk semua elektron
dan semua atom. Prinsip larangan Pauli ini dapat memprediksi semua
keadaan kuatum suatu atom serta mampu menjelaskan secara kuantitatif
susunan unsur kimia pada tabel periodik Mendeleyev (Dmitry Ivanovich Mendeleyev, 1834 – 1907, Rusia).
Penutup. Model-model atom atau khususnya model-model elektron yang kita kenal sekarang ini tidaklah muncul secara tiba-tiba namun merupakan hasil evolusi yang sangat panjang dalam upaya umat manusia untuk memahami struktur elementer pembentuk materi. Tonggak sejarah perkembangan model atom dimulai dari model atom Democritus yang bersifat kualitatif filosofis, sampai dengan model atom kuantitatif mekanika kuantum yang dapat menjelaskan karakteristik sifat-sifat elektron pada zat mampat. Aplikasi model atom khususnya model atom mekanika kuantum ini telah membawa umat manusia ke era solid state electronics dimana pada era ini hampir seluruh aspek kehidupan umat manusia sepertinya tidak bisa dilepaskan dari interaksinya dengan satu atau lebih gadget (komputer, hand phone, TV, kendaraan, dll.) yang bekerja berdasarkan prinsip-prinsip solid state electronics. Beberapa hal yang perlu difahami adalah: pertama, bahwa proses yang membawa umat manusia sampai ke model atom modern ini bukanlah hasil pekerjaan segelintir ilmuwan pada satu era saja, namun merupakan hasil kerja dari ribuan bahkan mungkin puluhan ribu ilmuwan di seluruh dunia dari zaman Yunani sampai abad ini. Kedua, model atom yang dibangun para ilmuwan pada suatu era merupakan modifikasi, koreksi dan/atau pengembangan dari model atom yang dibangun para ilmuwan pada era sebelumnya. Ini berarti bahwa kontributor bagi perkembangan model-model atom bukan hanya berasal dari para ilmuwan yang namanya disebutkan dalam tulisan ini, namun juga berasal dari para ilmuwan yang jumlahnya jauh lebih banyak serta memiliki latar belakang keilmuan beraneka ragam seperti fisika, kimia, matematika dan teknik, namun nama-namanya tidak dicantumkan dalam tulisan ini. Ketiga, pembahasan mengenai model atom ini belum lengkap karena belum membahas partikel subatomik pembangun inti atom yang lain yakni proton dan neutron yang baru ditemukan oleh Chadwick (James Chadwick, 1891 – 1974, Inggris) pada tahun 1932. Namun sangatlah beruntung bagi kita karena untuk keperluan aplikasi-aplikasi praktis khususnya pada teknologi divais elektronik, kita hanya perlu memahami perilaku elektron saja tanpa harus memahami prilaku inti atom dan elemen penyusunnya (proton dan neutron) di dalam zat mampat (condensed matter).
Pembahasan mengenai neutron (sesuai tema dari blog ini) akan coba dituangkan dalam tulisan-tulisan lain.
Penutup. Model-model atom atau khususnya model-model elektron yang kita kenal sekarang ini tidaklah muncul secara tiba-tiba namun merupakan hasil evolusi yang sangat panjang dalam upaya umat manusia untuk memahami struktur elementer pembentuk materi. Tonggak sejarah perkembangan model atom dimulai dari model atom Democritus yang bersifat kualitatif filosofis, sampai dengan model atom kuantitatif mekanika kuantum yang dapat menjelaskan karakteristik sifat-sifat elektron pada zat mampat. Aplikasi model atom khususnya model atom mekanika kuantum ini telah membawa umat manusia ke era solid state electronics dimana pada era ini hampir seluruh aspek kehidupan umat manusia sepertinya tidak bisa dilepaskan dari interaksinya dengan satu atau lebih gadget (komputer, hand phone, TV, kendaraan, dll.) yang bekerja berdasarkan prinsip-prinsip solid state electronics. Beberapa hal yang perlu difahami adalah: pertama, bahwa proses yang membawa umat manusia sampai ke model atom modern ini bukanlah hasil pekerjaan segelintir ilmuwan pada satu era saja, namun merupakan hasil kerja dari ribuan bahkan mungkin puluhan ribu ilmuwan di seluruh dunia dari zaman Yunani sampai abad ini. Kedua, model atom yang dibangun para ilmuwan pada suatu era merupakan modifikasi, koreksi dan/atau pengembangan dari model atom yang dibangun para ilmuwan pada era sebelumnya. Ini berarti bahwa kontributor bagi perkembangan model-model atom bukan hanya berasal dari para ilmuwan yang namanya disebutkan dalam tulisan ini, namun juga berasal dari para ilmuwan yang jumlahnya jauh lebih banyak serta memiliki latar belakang keilmuan beraneka ragam seperti fisika, kimia, matematika dan teknik, namun nama-namanya tidak dicantumkan dalam tulisan ini. Ketiga, pembahasan mengenai model atom ini belum lengkap karena belum membahas partikel subatomik pembangun inti atom yang lain yakni proton dan neutron yang baru ditemukan oleh Chadwick (James Chadwick, 1891 – 1974, Inggris) pada tahun 1932. Namun sangatlah beruntung bagi kita karena untuk keperluan aplikasi-aplikasi praktis khususnya pada teknologi divais elektronik, kita hanya perlu memahami perilaku elektron saja tanpa harus memahami prilaku inti atom dan elemen penyusunnya (proton dan neutron) di dalam zat mampat (condensed matter).
Pembahasan mengenai neutron (sesuai tema dari blog ini) akan coba dituangkan dalam tulisan-tulisan lain.
Referensi
- http://en.wikipedia.org/wiki/File:Daltons_symbols.gif (6 April 2010, 10.00 AM.)
- http://en.wikipedia.org/wiki/File:Plum_pudding_atom.svg
- http://www.daviddarling.info/encyclopedia/R/Rutherfords_experiment_and_atomic_model.html
- http://www.daviddarling.info/images/Balmer_series.gif
- http://www.cartage.org.lb/en/themes/Sciences/Astronomy/Modenastronomy/Interactionoflight/TheZeemanEffect/zeeman.gif
- http://en.wikipedia.org/wiki/File:Stern-Gerlach_experiment.PNG
- C. Kittel, Introduction to Solid Sate Physics, 6th ed., John Wiley & Sons, Inc., New York, 1986.
- N. W. Ashcroft, N. D. Mermin, Solid State Physics,
- G.E. Uhlenbeck and S. Goudsmit, Naturwissenschaften 47 (1925) 953.
- Gerlach, W., Stern, O. Das magnetische Moment des Silberatoms, Zeitschrift für Physik 9 (1922): 353–355.
- Geiger H., Marsden E., On a Diffuse Reflection of the α-Particles, Proceedings of the Royal Society, Series A 82 (1909): 495–500
- A. W. Beiser, Konsep Fisika Modern Ed. 4, Erlangga, 1987.
- R.L. Sproull and W.A. Phillips, Modern Physics 3rd Ed., John Wilwy & Sons, NewYork, 1980.
- P. Gasiorowicz, Quantum Physics, John Wiley & Sons, New York, 1974.
- E. Merzbacher, Quantum Mechanics, John Wiley & Sons, New York, 1988.





Tidak ada komentar:
Posting Komentar